12.1 Açlık Mide Suyu
- Nörolojik hastalık, koma hali vb. nedenlerle uyum gösteremeyen hastalardan, 10 yaşından küçük çocuklardan ve uyarılmış balgam alınamayan hastalardan alınır.
- Numune en az 5 mL olmak üzere mümkün olduğu kadar fazla miktarda hasta sabah aç karnına (hastanın gece uyku süresince yutmuş olduğu balgam) ve sabah yatağından kalkmadan/dik pozisyona geçmeden alınmalıdır. Tüberküloz tanısı için üç ardışık günde örnek alınır.
- Gastrik tüp ile ağız ya da burundan mideye ulaşılır.
- 25-50 mL serum fizyolojik verilir ve aspire edilir.
- Aspire edilen numune steril vida kapaklı bir kap ya da tüpe konulur.
- Nötralizasyon için 100 mg sodyum karbonat ilave edilmelidir.
Açlık Mide Suyu İçin Numune Red Kriterleri: Nötralize edilmeden 4 saatten daha fazla bekletilmiş numune olması
12.2 Ağız Mukoza Sürüntüsü
- Önce hastanın ağzını tuzlu su ile çalkalaması sağlanır.
- Eküvyon çubuğu ile ağız içindeki beyaz yama tarzı plaklardan, mümkünse plaklar kaldırılarak, sürüntü örneği alınır.
- Alınan numune; 1-2 mL steril Serum Fizyolojik (SF) içeren tüpe konarak laboratuvara gönderilir.
12.3 Akıntılı Sinüslerden İrin ya da Eksüda Örneği
Çıplak gözle görülebilen granüllerin varlığı açısından incelenmeli ve granüllerden zengin bölgeden, sinüsün duvarından steril pamuklu swab ya da spatula yardımı ile kazıyarak örnek alınmalıdır.
12.4 Anal (Selofan) Bant
A. Genel Bilgiler: Selofan bant yöntemi ile numune, Resim 1'de tarif edildiği gibi alınır. Tanının başarısı numune alma zamanı ile yakından ilişkilidir. Numune sabah uyandıktan sonra, hasta tuvalete gitmeden ve bölgesel temizlik yapılmadan önce alınmalıdır. Bu nedenle işlemin evde yapılması gereklidir. Lam verilirken numunenin nasıl alınacağı resim eşliğinde tarif edilmeli; ayrıca dikkat edeceği güvenlik hususları da (eldiven ve el yıkama) belirtilmelidir.
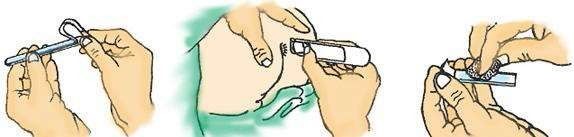
Resim 1: Selofan bant yönteminin uygulanışı: (a) Lama yapıştırılmış selofan bant uç kısmından çekilerek kaldırılır, (b) Bandın yapışkan yüzü perianal bölgeye birkaç kez değdirilip çekilir, (c) Bant tekrar lama yapıştırılıp laboratuvara ulaştırılır.
B. Örneklerin Saklama ve Taşınması: Örnek oda ısısında saklanmalı ve laboratuvara gönderilmelidir.
C. Anal Bant için Numune Ret Kriterleri
- Lam üzerine incelemeyi engelleyecek şekilde etiket/barkod yapıştırılmış örnekler.
- Kırılmış anal bant örnekleri.
12.5 Balgam
Tüberküloz tanısı ve balgam kültürü için alınacak balgamın ideal olarak kurumda, hastaların balgam örneklerini toplamaları için biyogüvenlik açısından özel olarak tasarlanmış, negatif basınçlı özel havalandırma sistemi bulunan, HEPA filtreli, ultraviyole lambaların bulunduğu, hava dezenfektan cihazı içeren kabin veya odalarda alınmasıdır. Bu özelliklere sahip örnek alma odası yoksa klinik ve laboratuvar dışında, balkon veya bahçe gibi açık havada, tenha bir yerde, diğer insanlardan uzak bir mesafede ve mümkünse bol güneşli bir ortamda alınmalıdır. Klinik içindeki oda veya tuvalet gibi yerlerde hastadan balgam çıkarmasını istemek sakıncalıdır. Eğer hasta kendi evinde balgam çıkaracak ise bu işlemi; bol güneş alan bir balkonda veya varsa bahçede yapmalıdır.
Tüberküloz şüpheli hastalardan sabahları aç karnına, üç gün üst üste örnek alınmalıdır. Hastaya bir kap verip ertesi gün örneği getirdiğinde yeni kabı vermek daha uygun olabilir. Ancak hasta, üç gün üst üste sabah ilk balgam örneğini verecek durumda değil ise, İlk balgam örneği; klinik başvuru sırasında (anlık), ikinci balgam örneği; ikinci gün sabahı (evde), üçüncü balgam örneği; ikinci balgam örneğini getirdiğinde (anlık) veya üçüncü gün sabahı (evde) alınarak gönderilmelidir.
Balgam Örneği Alınması;
- Sabah aç karnına önce dişlerini fırçalaması veya ağzını iyice çalkalaması istenir. Yiyecek artıkları, ağız florası, tükürük ve ilaçlar ile örneğin kontaminasyonunu önlemek için hastaya balgam çıkarmadan önce ağzını bol suyla çalkalaması gerektiği hatırlatılmalıdır.
- Bir bardak ılık su içmesi önerilir. Kendiliğinden balgam çıkaramayan hastalara öncelikle bol sıvı alması, kültürfizik hareketleri yapması veya merdiven inip çıkması tavsiye edilebilir.
- Örnek kabının ağzını dikkatli bir şekilde açması, kapağı uygun, temiz bir yere koyması söylenir.
- Derin bir nefes alıp bir süre nefesini tuttuktan sonra derin ve kuvvetlice öksürük ile balgamını doğrudan kabın içine çıkartması istenir. Balgam ve tükürük farkını tam olarak bilmeyen hastalar yanlışlıkla balgam çıkarmadan kaba tükürmesinler diye, hastaya "balgamını kaba tükür" denilmemelidir. Hastalara tükürük veya nazofaringeal sekresyonların (burun ve yutak kaynaklı sıvıların) balgam olmadığı ve bu nedenle laboratuvarda test için uygun örnek olarak kabul edilmediği anlatılmalıdır.
- Örnek kabının kapağını dikkatli bir şekilde sıkıca kapatması ve bu şekilde, her örnek için ayrı örnek kabı kullanması söylenir.
- Her kabı aynı gün en geç iki saat içerisinde laboratuvara getirmesi istenir.
Balgam İçin Numune Ret Kriterleri: Numunenin tükürük olması, 24 saat süre ile biriktirilmiş olması, içinde yiyecek artıklarının olması, şehirlerarası taşıma süresinin 3 günü geçmesi.
12.6 Uyarılmış Balgam
- Balgam çıkaramayan ayaktan hastalardan alınmalıdır.
- Nebülizatör yardımı ile %3-10 hipertonik tuzlu su 15-20 dk boyunca solutularak, derin inspiryum ve öksürük ile balgam örneği uygun numune kabına toplanır.
- En az 10 mL miktarda indükte balgam örneği alınarak gönderilmelidir.
- İndüklenmiş balgam numunesi görünüm açısından tükürüğe benzediği için numune yanlışlıkla reddedilmesin diye istem kâğıdına mutlaka "uyarılmış balgam" notu eklenir.
12.7 BAL, Bronş Yıkama Sıvısı, Fırçalama Numunesi
- Hiçbir şekilde balgam veya uyarılmış balgam örneği veremeyen tanı konulamamış olgulardan alınır.
- Numune, hekim tarafından bronkoskop ile alınmalıdır.
- Bronkoskopi esnasında çeşme suyu kullanılması saprofit mikobakterilerle kontaminasyona yol açabildiği için steril distile su veya steril tuzlu su kullanılmalıdır.
- Bronkoskop dezenfeksiyonu eksiksiz olarak yapılmalı ve tüm işlemler uygun güvenlik standartları altında gerçekleştirilmelidir.
- 5-10 mL bronş lavajı/BAL örneği, 5 mL serum fizyolojik içerisine alınan fırçalama örneği ve en az 3 mL trakeal aspirat steril vida kapaklı tüpte ya da luer tipi kapaklı enjektörde alınarak gönderilmelidir.
12.8 Beyin Omurilik Sıvısı (BOS)
Santral Sinir Sistemi enfeksiyonlarının tanısında BOS, ventriküler şant sıvısı, apse aspirasyon materyali ve biyopsi örnekleri incelenebilir. BOS örneği yalnızca tanı amacıyla, deneyimli personel tarafından, aseptik şartlarda alınmalıdır.
BOS'un Laboratuvara Gönderilmesi:
- BOS alınır alınmaz (tercihen 1 saat içinde) inceleneceği mikrobiyoloji laboratuvarına biyogüvenlik kurallarına uygun olarak ulaştırılmalıdır. BOS örnekleri mesai saatleri içerisinde alınmalı ve derhal laboratuvara ulaştırılması sağlanmalıdır.
- En az 2 mL örnek alınmalıdır (şüphelenilen etkene göre ilgili laboratuvar ile görüşülmelidir).
- Bakteriyel ve fungal patojenlerin araştırılması amacıyla alınmış BOS örneği ASLA buzdolabına konulmaz, oda ısısında gönderilmelidir, aşırı soğuğa, aşırı sıcağa ya da güneşe maruz bırakılmaz!
- Virolojik ve parazitolojik testlerde kullanılması amacıyla alınan BOS örnekleri soğuk zincir şartlarında gönderilmelidir.
- Eğer hastalığın etkeni olarak Neisseria meningitidis'den şüpheleniliyorsa ve incelemeye alınıncaya kadar birkaç saat geçeceği tahmin ediliyorsa BOS bu süre boyunca (tüpün kapağı gevşetilerek) 35oC'de ve %5 CO2'li atmosferde (CO2 inkübatör veya mumlu jar içinde) tutulabilir; bu girişim bakterinin yaşam şansını artıracaktır.
Trans Isolate (T-I) Besiyeriyle Laboratuvara Gönderilmesi:
- Eğer BOS'un laboratuvara aynı gün içinde ulaştırılması mümkün görünmüyorsa, bakteriyel patojenler için BOS örneği (1 mL) tercihen T-I besiyerine konur ve gönderilir). T-I besiyeri yoksa bir pediatrik kan kültür şişesi bu amaç için kullanılabilir.
- T-I besiyeri (oda sıcaklığında tutulan veya 35oC'de ısıtılmış) şişesinin tepesindeki lastik membran alkol ve iyotlu dezenfektan ile silinir. Kurumaya bırakılır.
- Daha sonra tüp içindeki BOS bir şırınga yardımı ile alınarak 1 mL örnek T-I besiyerinin içine inoküle edilir.
- Kalan örnek Gram boyama vb. incelemeler için tüp içinde -aksi belirtilmedikçe- oda sıcaklığında
laboratuvara gönderilir.
- T-I besiyeri agar fazı ve sıvı fazı aynı şişe içinde olan bifazik bir besiyeridir. (Resim 2) Özellikle meningokokların ve diğer bakteriyel etiyolojik ajanların BOS'dan primer kültürleri için ideal bir besiyeridir.

Resim 2. Bifazik Trans-Isolate (T-I)
En önemli özelliği bakteriyel menenjit etkenleri için hem taşıma besiyeri hem de primer kültür besiyeri olarak kullanılabilmesidir.
- DSÖ; meningokok, Hib ve pnömokok, kaynaklı bakteriyel menenjit veya invaziv hastalık sürveyansı kapsamında, laboratuvar tanısında izolasyon şansını önemli ölçüde artırdığı için bu besiyerini önermektedir. Ticari olarak mevcut değildir; Referans Laboratuvar tarafından hazırlanır ve sahaya, Halk Sağlığı Müdürlüklerine dağıtılır.
- BOS inoküle edilmiş T-I şişeleri hasta bilgileri, tarih ve inokülasyon saati yazılarak etiketlenir. İnokülasyondan sonra şişe 35oC'de bir gece inkübe edilir. Alternatif olarak 7 güne kadar da inkübe edilebilir.
- Üremenin teşviki için ortam atmosferi organizmaya ulaşmalıdır; bir havalandırma iğnesi ile (steril pamuk tıkaçlı bir şırınga iğnesi olabilir) şişe tepesindeki lastik membrandan hava deliği açılmalıdır.
- Eğer taşıma gecikecekse hava deliği açılmış şişeler hafif yüksek oda sıcaklığı (25o-30oC) şartlarında birkaç gün tutulabilirler.
- Takiben laboratuvara nakledilirlerken havalandırma iğneleri çıkarılır! Çünkü taşıma esnasında sızdırmazlık sağlanması gerektiği için şişelere hava deliği açılmaz.
- Laboratuvara ulaşır ulaşmaz hava deliği yeniden açılmalıdır. Bu işlemlerde asepsiye azami dikkat gösterilmelidir. BOS örneğinin alınmasından laboratuvara ulaşmasına kadar her aşamada aseptik teknik kullanılması ve kontaminasyondan kaçınılması esastır!
12.9 Boğaz Sürüntüsü
- Ağız içi ve farinks net olarak görülecek bir şekilde aydınlatılır.
- Dil, bir dil basacağı ile bastırılır ve steril eküvyon tonsillalar üzerine döndürülür. Bu işlem sırasında eküvyonun yanak iç kısımlarına ve dile değdirilmemesine özen gösterilir. (Resim 3)
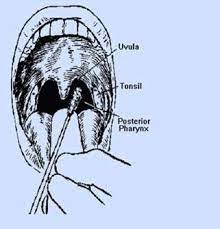
Resim 3: Boğaz Sürüntüsü alınması
- Tonsillalar üzerinde membran, beyaz noktalar veya yangılı/hiperemik alanlar görülüyorsa eküvyon özellikle bu kısımlara hafifce bastırılıp numune alınır.
- Eğer herhangi bir membran varsa (psödomembran) kenarından kaldırılır; eküvyon membranın altına itilerek derinde yerleşim gösteren bakterilerin alınması sağlanır.
Alınan numune;
Bakteriyolojik incelemeler için kömürlü Amies transport besiyerine veya Stuart besiyerine, Virolojik incelemeler için, plastik saplı steril dakron
eküvyon tonsiller ve posterior farinkse kuvvetlice sürtülerek örnek alınır ve viral taşıma besiyeri içeren tüpe konur. (Resim 4)
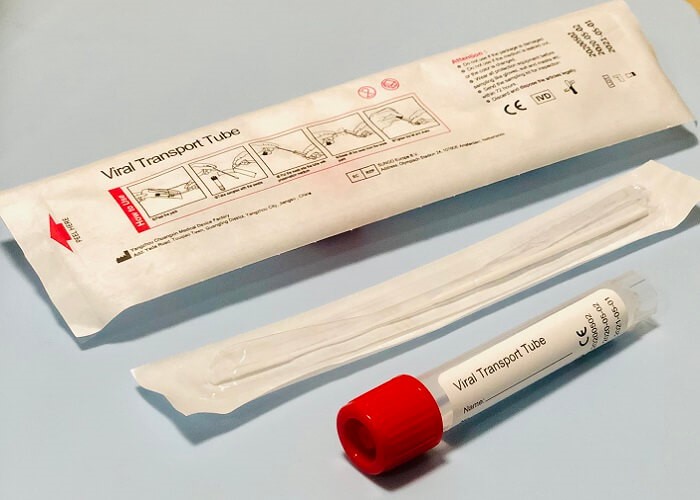
Resim 4: Viral Taşıma Besiyeri (VTM)
Not:
Boğaz sürüntüsü çoğunlukla, influenza virusunun (sezonal) replike olmadığı squamoz epitel hücresi içermektedir. Bu nedenle tek başına alınması uygun değildir. En uygunu burun ve boğaz sürüntüsünün birlikte alınmasıdır.
Solunum Sistemi Örnekleri İlgili Videolar:
https://www.klimud.org/content/159/videolar
https://vimeo.com/234900862/6922caf2b0
Eğer hazır ticari besiyeri kullanılıyor ise eküvyon direkt olarak konularak tüp kapatılır.
12.10 Burun Sürüntüsü
- Esnek, ince saplı bir steril eküvyon ile (dacron/polyester eküvyon) damağa paralel olacak şekilde bir burun deliğinden girilir.
- Steril swab burun deliğinden en az 1 cm içeri sokulur.
- Sekresyonların yeterince emilmesi için birkaç saniye bekletildikten sonra yavaşça ve döndürülerek çıkarılır.
- Diğer burun deliğinden yine aynı eküvyonla işlem tekrarlanır ve uygun taşıma besiyeri içeren tüpe konur. (Resim 7)
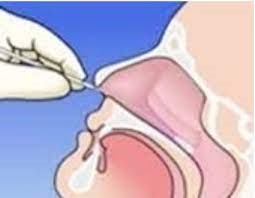
Resim 7. Nazal Sürüntü Alınması
Alınan numune;
Bakteriyolojik incelemeler için kömürlü Amies transport besiyerine veya Stuart besiyerine, Virolojik incelemeler için, viral taşıma besiyeri içeren tüpe konur.
12.11 Deri ve Deri Eklentileri
12.11.1 Deri Mukozaları İçin Kazıntı Örnekleri:
- Örnek alınmadan hemen önce lezyon bölgesi %70'lik etil alkol ile temizlenir. Bisturi ucu veya lam kenarı yardımıyla sağlam deri ile deri lezyonu arasından lezyonun aktif kenarından dikkatlice kazıntı yapılır. Bu işlem esnasında lezyon kanatılmamalıdır! Birden çok lezyon var ise en yeni lezyondan örnek alınmalıdır. Alınan deri kazıntısı en az raptiye başı büyüklüğünde olmalıdır.
- Lezyonda kıl kökleri varsa, kıl cımbızla alınmalıdır. Veziküller var ise, en yeni veziküllerin tepelerini kesip almak gerekir.
- Örnek petri kutusuna alındıysa kenarı selofan bant ile kapatılır. Üzerine hasta ile ilgili bilgiler yazılır.
- Kandidoz kuşkusunda; eğer "uydu" lezyonlar varsa, en yeni uydu lezyondan, yok ise lezyonun kenarlarından kazıyarak örnek alınmalıdır. Kıvrım yerlerindeki lezyonlar ıslak ve çok yangılı ise ıslatılmış bir pamuklu swabı yüzeye iyice bastırıp döndürerek sürüntü örneği alınmalıdır.
- Parazitolojik incelemeler için steril bistüri yardımıyla dikkatli bir şekilde alınan deri kazıntı materyali steril boş bir tüp içerisine eklenen steril serum fizyolojik içerisinde gönderilmelidir.
12.11.2 Kıl Örnekleri
- Makas veya cımbız ile etkilenmiş saçlı bölgeden gövdesi sağlam 10-12 kıl toplanır; toplanan kıllar temiz Petri kutusu veya koyu renkli kâğıt üzerine alınır.
- Örnek petri kutusuna alındıysa kenarı parafilm (yoksa selofan bant) ile kapatılır. Üzerine hasta ile ilgili bilgiler yazılır.
- Örnek kâğıt üzerine alındıysa paket şekline getirilir. Paket zarf içine konur ve zarf kapatılır. Zarfın üzerine hasta ile ilgili bilgiler yazılır.
Önemli not: Saçlı deri ve saçsız deri enfeksiyonlarında -olanaklı ise- Wood ışığı incelemesi yapılmalı ve floresan veren bölgelerden örnekleme yapılmalıdır.
12.11.3 Tırnak Örnekleri
- Örnek alınmadan önce tırnak %70'lik etil alkol ile temizlenir. Bu işlem sırasında GAZLI BEZ kullanılır; kesinlikle pamuk kullanılmaz! Etkilenmiş tırnaktan mümkün olduğunca eski, ölü doku kesilip uzaklaştırılır ve tırnak yatağı ya da tırnağın enfekte canlı doku sınırından kazıntı yapılır.
- Örnek petri kutusuna alındıysa kenarı selofan bant ile kapatılır. Üzerine hasta ile ilgili bilgiler yazılır. Örnek kâğıt üzerine alındıysa paket şekline getirilir. Paket zarf içine konur ve zarf kapatılır. Zarfın üzerine hasta ile ilgili bilgiler yazılır.
12.11.4 Peteşial Sıvı (Menenjit Tanısı İçin)
- Numune alınacak deri bölgesine %70'lik alkol ile antisepsi uygulanır.
- Steril bisturinin ucu ile peteşiyal lezyon üzerindeki deri hafifçe kazıntı yapılarak kaldırılır.
- Bisturinin kör tarafı ile peteşiyal alan tabanından epitel içerecek şekilde kazıntı yapılır ve açılan kısımdan sızan eksuda ile birlikte steril Pastör pipeti yardımıyla numune konur.
- Numuneden bir damla lam üzerine yayma yapılır ve havada kurutulur.
- Alev ile sabitlenir. Uygun bir lam kutusunda laboratuvara gönderilir.
- Peteşial sıvı ≤1 saatte incelemeye alınacaksa 1 mL steril serum fizyolojik içeren tüpe konur ve gönderilir; alınamayacaksa pediatrik kan kültür şişesine konmalı ve oda ısısında laboratuvara gönderilmelidir.
- Peteşial sıvı ile birlikte hasta başında yapılan yayma da laboratuvara gönderilir.
12.12 Dış Kulak Yolu Akıntısı
Debris veya salgılar, dış kulak kanalından alınmalıdır. Alınan örnekler, taşıma besiyeri ile laboratuvara gönderilmelidir.
12.13 Dışkı
Dışkı örnekleri özellikle ishal başladıktan hemen sonra (virüslar için ilk 7 gün, bakteriler için ilk 4 gün içinde) ve antibiyotik tedavisi başlanmadan önce alındığında en yararlıdır. Bakteriyel, viral ve paraziter ishal etkenlerinin incelenmesinde genellikle dışkı örnekleri tercih edilir.
Dışkı Örneklerinin Toplanması
Dışkı Kabı: Temiz, kuru, ağzı sızdırmaz kapaklı kap (Resim 8) ve/veya bakteriyel taşıma besiyeri (Cary Blair veya Amies veya Stuart- (Resim 9) (her hasta için birer adet)
Resim 8: Temiz, sızdırmaz, vida kapaklı dışkı kabı

Resim 9: Cary-Blair taşıma besiyeri
Örnek Toplama Yöntemi
- Örneklerin alınacağı kabın temiz olması, deterjan, dezenfektan veya idrarla kontamine olmaması gereklidir.
- Dışkı örnekleri sürgülerden alınmamalıdır.
- Ancak çocuklardan bezleri ters bağlanarak örnek alınabilir.
- Ağzı sızdırmaz kapaklı dışkı kaplarına bakteriyolojik, virolojik ve parazitolojik inceleme için 20 mL veya 20 g taze dışkı örneği alınır.
- Bakteriyolojik inceleme için örneklerin bakteriyel taşıma besiyerinde gönderilmesi tercih edilir. Hastalardan taze dışkı sürüntü örneği (tercihen bir saat beklemiş dışkıdan) alınır. Eküvyon tüpün dibine doğru itilir ve tüpün kapağı sıkıca kapatılır.
- Parazitolojik inceleme için çalışmanın en az üç kez tekrarlanması tercih edilir. Dışkı örnekleri alındıktan sonra temiz, kuru, ağzı sızdırmaz kapaklı bir kaba alınmalıdır. Eğer formaldehit, SAF (sodyum asetat-asetik asit-formaldehit) veya PVA (polivinil alkol) gibi koruyucu solüsyonlar mevcut ise dışkı üç ayrı kaba bölüştürülmelidir. Birincisine koruyucu konulmamalı, ikincisine %10'luk formaldehit, üçüncüsüne ise dışkının üç katı kadar PVA veya SAF ilave edilmeli ve hangisinde koruyucu bulunduğu belirtilmelidir. Koruyucu içindeki dışkı oda sıcaklığında tutulabilir. Diğer dışkı örneği herhangi bir fiksatif koymaksızın soğuk zincir şartlarında 4-8oC'de yollanmalıdır.
- Virolojik incelemeler için dışkı ile virüs atılımı değişkenlik gösterebileceğinden özellikle akut flask paralizi (AFP) örneklerinde 24-48 saat ara ile en az iki örnek alınmalıdır.
Dışkı Örneklerinin Saklama ve Taşınması
- Direkt taze dışkı 2 saat içinde işlenir ya da buzdolabında 4-8oC'de saklanır.
- Taşıma besiyerine alınan veya fiksatif içinde gönderilen örnekler 4-8oC'de saklanır.
- Örnekler, hastadan alındıktan sonra 24 saat, en geç 48 saat içinde test edilir. Eğer test edilemeyecekse -20oC'de saklanır. Taşıma besiyerine konulan ve 4-8oC'de bekletilen örneklerde 7 güne kadar patojenlerin saptanma olanağı olmakla beraber ilk bir iki günden sonra etkeni üretme şansı giderek azalmaktadır.
Dışkı Örnekleri İçin Numune Red Kriterleri
- Numunenin alımından sonra 2 saat geçtiği halde transport besiyerine alınmadan gelen dışkı numuneleri reddedilmelidir.
- Transport besiyerinde 4oC'de 3 günden fazla beklemiş numuneler veya transport besiyerinde olduğu halde 24 saatten daha uzun süre oda ısısında bekletilerek gelen numuneler reddedilmelidir.
- Hastanede 3 günden uzun süredir yatan hastalardan rutin dışkı kültürü bakılmaz. Ancak hastanın immünsüprese bir durumu varsa ve hastanede bir salgın söz konusu ise bu durumlarda numune işleme alınır.
- İdrar veya baryumla (Son 7-10 gün içinde lavman veya kolonoskopi yapılmış hastanın dışkı örneği) karışık dışkı numuneleri işleme alınmaz.
- Tuvalet kâğıdı ile alınan dışkı numunesi işleme alınmaz.
- Aynı kişiden 24 saat içinde birden fazla; 3 haftalık zaman içinde 3'ten fazla dışkı kültürü istenmesi durumunda numune işleme alınmaz.
- Herhangi bir transport besiyerine alınmadan kuru eküvyon ile gönderilen veya yüzeyi kurumuş dışkı red kriterini oluşturmaktadır.
Doku Biyopsisi
- Aseptik şartlarda, hekim tarafından alınır. En az 2-3 gr doku, 3-4 parça halinde alınmalıdır (kültür yapılacaksa en az 2 parça).
- Alınan numuneler serum fizyolojik içinde (Legionella analizi için distile suda) oda ısısında laboratuvara gönderilmelidir.
- Parazitolojik incelemeler için bir parçası temiz 2-3 lama bastırarak preparat hazırlanır.
Doku Biyopsi İçin Numune Red Kriterleri:
- Formalin mikroorganizmaları inaktive ettiği için formalinli numuneler çalışmaya alınmaz.
- Yetersiz miktarda örnek, gazlı bez, pamuk gibi materyale sarılmış örnek olması.
12.14 Göz Enfeksiyonlarına Yönelik Örnekler
12.14.1 Konjonktival Örnek
- Gözü ilgilendiren enfeksiyonlarda farklı etken olasılıklarını değerlendirebilmek için -korneal kazıntı yapmadan önce genel amaçlı olarak- konjonktival örnek alınması önerilir. Yalnız biri enfekte olsa bile, karşılaştırma amacıyla (mevcut florayı belirleyebilmek için) her iki gözden birden örnek alınmalıdır.
- İki ayrı swab önce SF ile ıslatılır. Konjonktiva kısmında eküvyon çevrilerek, her iki gözden ayrı ayrı örnek alınır. Mümkünse, örnekler hemen hasta başında besiyerine (Kanlı agar, Çikolata agar) ekilir. Besiyerine hemen ekim imkanı yoksa eküvyonlar 1 mL SF içeren steril vida kapaklı tüp içinde laboratuvara gönderilir.
- Ayrıca hemen her bir eküvyon ayrı ayrı lam üzerine 1-2 cm alana sürülerek yayma yapılabilir. Yaymalar havada 10 dk kadar kurutulur ve yaymanın üzerine alkol damlatılarak sabitlenir.
12.14.2 Kornea Kazıntısı
- Örnek oftalmolog tarafından, mikrobiyoloji uzmanının desteği ile örneğin ekimi de planlanarak, alınmalıdır. Önce (diğer enfeksiyon ihtimallerini de değerlendirmek için) iki ayrı eküvyonla her iki konjonktivadan örnek alınır.
- Takiben her iki göze 2 damla lokal anestezik damlatılır. Steril spatula kullanılarak ülser ya da lezyondan kazıma yapılır ve bu kazıntı direkt kültür besiyerine inoküle edilir. Ayrıca spatula 2 ayrı lam üzerine 1-2 cm alana sürülerek yayma yapılır. Yaymalar havada 10 dk kadar kurutulur ve yaymanın üzerine alkol damlatılarak sabitlenir. Ekim yapılmış plaklar ve hazırlanan lamlar laboratuvara gönderilir.
- Parazitolojik inceleme için, kornea kazıntı materyali steril boş bir tüp içerisine eklenen steril serum, fizyolojik içerisinde gönderilmelidir.
12.14.3 Vitreus Sıvısı
Örnek oftalmolog tarafından mikrobiyoloji uzmanından destek alınarak alınmalıdır. Sıvının iğne aspirasyonu için göz hazırlanır. Örnek steril vida kapaklı bir tüpe konur veya küçük miktarları hazırda bulunan besiyerlerine ekilir.
12.15 İdrar (Orta akım)
- Dış ürogenital bölge temizlendikten sonra steril şartlarda idrar alınır.
- Mikolojik inceleme için sabah ilk idrarı tercih edilmelidir.
- Üriner sistem tüberkülozu için ardışık üç gün alınan sabah idrarı tercih edilir. İdrar veremeyen hastalardan mesaneden kateter ile ya da suprapubik aspirasyon ile alınabilir. Üriner sistem tüberkülozu şüphesinde en az 40 mL, üç gün üst üste sabah idrarı şeklinde alınmalıdır.
- Schistosoma spp. aranması için gönderilecek idrar örneği, gün ortasında alınan tüm idrar örneği şeklinde olmalıdır.
Kadın Hastaların Numune Verirken Dikkat Edilmesi Gereken Hususlar;
- Hastaya idrar çıkış bölgesini steril antiseptik bir ped veya sabunlu su ile ıslatılmış gazlı bez ile üretral ve vaginal bölgenin önden arkaya doğru dikkatlice temizlemesi, su ile ıslatılmış gazlı bez kullanılarak bölgenin aynı şekilde durulanması,
- Tuvalete idrar yapmaya başladıktan sonra idrar akışı düzenli oluncaya kadar bekleyip sonra 5 -10 mL idrarı idrar kabına alması, idrar kabını genital bölge ile temas ettirmemesi,
- İdrar kabının üzerine, ad-soyad ve toplama zamanını belirten bir etiket yapıştırın ve en kısa sürede laboratuvara gönderilmesi bilgileri verilir. Numune 1 saat içinde laboratuvara ulaştırılamayacaksa taşıma süresi dâhil 24 saate kadar +4 oC'de muhafaza edilebilir. Üriner sistem infeksiyon tanısı için alınmış idrar numuneleri dondurulmaz.
Erkek Hastalar Numune Verirken Dikkat Edilmesi Gereken Hususlar;
- Sabunlu su ve sonra temiz su ile penisin ucunu yıkanması ve kurumaya bırakılması,
- Tuvalete idrar yapmaya başlayıp idrar akışı düzenli oluncaya kadar bekleyip sonra 5-10 mL idrarı idrar kabına alması, idrar kabını genital bölge ile temas ettirmemesi,
- İdrar kabının üzerine, ad-soyad ve toplama zamanını belirten bir etiket yapıştırın ve en kısa sürede laboratuvara gönderilmesi bilgileri verilir. Numune 1 saat içinde laboratuvara ulaştırılamayacaksa taşıma süresi dahil 24 saate kadar +4 oC'de muhafaza edilebilir. Üriner sistem infeksiyon tanısı için alınmış idrar numuneleri dondurulmaz.
Kateterize edilmiş bir hastadan idrar numunesi elde edilirken; 21-23 no' lu iğne ucu ve 3 mL'lik enjektör kullanın. Antiseptik bir ped ile kauçuk kateterin alt ucundaki bir bölgeyi hazırlayın. 45 derecelik bir açıyla iğneyi katetere sokun ve dikkatli bir şekilde enjektör pistonunu çekerek idrar toplayın.
Not: İdrar örneği drenaj torbasından alınmamalıdır.
İdrar Örneği İçin (Orta akım) Numune Red Kriterleri:
- 24 saatlik biriktirilmiş ve/veya bekletilmiş idrar olması.
- Viral etkenlerin PCR yöntemi ile incelenmesi amacıyla alınan idrar örneğinin laboratuvara gönderilmesi 24 saati geçecekse viral etkenlerin idrar asiditesinden etkilenmemesi için idrar kabına alkali vasat eklenmesi gereklidir.
Alkali vasat:
12.16 İdrar (Üretrit Tanısı İçin)
- Üretrit tanısı için sabah ilk idrar olması veya son iki saat içinde idrar yapmamış olması ve/veya üretral akıntı örneği alındıktan sonra idrarın alınması idealdir.
- Steril idrar kabı içine idrarın ilk kısmı 5-10 mL olacak şekilde alınır.
- Diğer bir steril kap içine idrarın orta kısmı 5-10 mL alınır.
- Erkeklerde idrarın prostat masajı sonrasında alınması uygundur.
- Örnekler herhangi bir antiseptik madde uygulanmadan alınmalıdır.
- İdrar örnekleri, idrar kabı ile oda ısısında laboratuvara gönderilir.
12.17 İnce İğne Aspirasyonu (Şark Çıbanı için)
- Lezyon tabanından deri içine enjektör ile 0.1 mL steril serum fizyolojik verilir ve hafifçe pompalanarak geri çekilir.
- 0.1-0.2 mL numune alınır. Hemen laboratuvara gönderilemeyecekse yayma preparat yapılır.
- Yayma yapılmamış veya besiyerine alınmamışsa; herhangi bir koruyucu madde içermeyen steril, vida kapaklı plastik bir tüpe aktarılır (taze numune).
İnce İğne Aspirasyonu İçin Numune Red Kriterleri:
- Koruyucu içeren tüpe alınmış aspirasyon örnekleri.
- Kan kültürü şişesine alınmış aspirasyon örnekleri.
- Enjektör içerisinde gönderilen aspirasyon örnekleri.
12.18 Kan Örnekleri
12.18.1 Kan Kültürü
Sepsis tanısı mikrobiyoloji laboratuvarlarının en önemli görevlerinden birisidir. Tespit ve tedavi edilmeyen sepsis ölümcül olabilmektedir. İyi bir teknikle kan numunesi alınması hızlı laboratuvar sonucunu da beraberinde getirmektedir. Aşağıdaki prosedür servisinizde iyi kan numunesi almak üzere düzenlenmiştir.
Otomatize Kan Kültürü Cihazları otomatize kan kültürü takip sistemi olup kan kültürü şişelerinizi inkübe eder, mikroorganizma üremesine bağlı olarak enfeksiyon etkenini tespit eder. Yaş gruplarına ve mikroorganizma grubuna göre farklı renklerde kan kültür şişeleri bulunmaktadır.
- Sarı renkli şişeler pediatrik kullanım için olup, en az 2 mL'ye kadar kan alınması gerekirken, yenidoğanlardan en az 1 mL'ye kadar kan alınmalıdır.
- Yeşil renkteki şişeler aerop şişeler olup, optimum 10 mL kan alınmalıdır.
- Turuncu renkteki şişeler anaerop şişeler olup, optimum 10 mL kan alınmalıdır.
(Laboratuvarımızda turuncu renkteki şişe anaerop kültür yapılmadığından kullanılmamaktadır).
Kan Kültürü Numunesi Alınırken Dikkat Edilmesi Gereken Hususlar;
- Kan numuneleri mümkünse tedaviye başlamadan önce almalıdır. Hasta eğer antibiyotik kullanıyor ise son dozdan en uzak zamanda yeni doz verilmeden hemen önce alınmalıdır.
- Hastalığın başlangıcında 15-30 dk arayla iki veya üç tüp alınmalı; 48 saat sonra üreme olmazsa tekrarlanmalıdır.
- Organizmalar endokardit gibi intravasküler enfeksiyonlar esnasında sürekli yayılır fakat gizli enfeksiyonlar esnasında ise aralıklarla yayılırlar. Bazı gizli enfeksiyonlarda ön görülebilir ateş şekilleri vardır. Böyle durumlarda en uygun olanı ateş pik yapmadan 30 dk önce kan kültürü için kan alınmasıdır. Pratikte uygulanabilecek en iyi zamanlama ateş ortaya çıkmaya başladığı anda kan kültürü almaktır.
- Kateter kaynaklı sepsis düşünülmedikçe kateterden kan kültürü alınmaz.
- Hematolojik, biyokimyasal ve benzeri tetkikler alınırken kan kültür örneği alınmaz. Çok amaçlı alımlarda kontaminasyon riski artar.
- İlaç verilen damar içi kateterler kan alımı için kullanılmamalıdır.
- Kan eklenmiş olan kültür şişeleri laboratuvara gönderilene kadar oda ısısında kalmalı ve en kısa sürede laboratuvarımıza gönderilmelidir.
- Tüm işlemlerde cerrahi aseptik teknik uygulanır.
- Gerekli malzemeler hazırlanır, eller, "El Yıkama Talimatı" na uygun yıkanır.
- Şişe yüzeyini, besiyerini ve tabandaki sensörü kontrol edilir. Besiyerinin temiz ve sensörün de sağlam (gri renkte) olduğu kontrol edilir. Sensör rengi sarı ise şişe kullanılmaz.
- Kan kültürü örneği en sık kübital, ikinci sıklıkta da femoral damarlardan alınır. Mecbur kalınmadıkça el üstü venlerinden ve ayak venlerinden örnek alınmaz.
- Numune alınacak bölgede merkezden çevreye doğru 5-6 cm'lik bir çap oluşturacak şekilde %70 lik alkolle silinir (1-3 dk süreyle kuruması beklenir).
- İkinci olarak ayrı bir pamukla, aynı hareketlerle batikonla silinir.
- Üçüncü olarak tekrar %70 lik alkollü pamukla silinir ve el değmeden damara enjektörle girilerek kan alınır. El değmek zorunda kalınıyorsa steril eldiven kullanılabilir.
- Yeterli miktarda kan alındıktan sonra damardan çıkılır.
- Daha sonra damar üzerine gazlı bez ile baskı uygulanır.
- Numune konulmadan önce kapağın altındaki lastik bölge steril edilir.
- Kan kültür şişelerine numune konulduktan sonra, lastik tıpa tekrar %70'lik alkol ile silinir. Kanı şişeye alındıktan sonra hafifçe alt üst edilir.
- Kan örneği şişeye enjekte edildikten sonra kanın pıhtılaşmaması ve besiyeri ile karışması için şişe birkaç kez hafifçe çalkalanır.
- Kan kültürü alınırken iki kan kültürü arasında en az 15-30 dakika olur.
- Şişe üzerine bir etiket yapıştırılacak ise şişenin üzerindeki barkodun üzerine gelmeyecek bir alan seçilmelidir. Hastanın almakta olduğu antibiyotik varsa mutlaka Test İstek Formu'na yazılarak porter ile hemen laboratuvara gönderilir.
- Eğer hasta antibiyotik tedavisi altında ise kan kültürü, bir sonraki antibiyotik dozundan hemen önce alınmalı, daha sonra antibiyotik verilmelidir.
- Kan kültür şişeleri oda sıcaklığında tutulmalıdır; kesinlikle buzdolabında saklanmaz.
- Şişeleri en kısa sürede (otomatik cihaza ait şişeler için belirtilen süre içinde) laboratuvara gönderilmelidir.
- Eğer hemen laboratuvara ulaştırmak mümkün değilse, otomatik cihaza ait olmayan kan kültürü şişeleri 18 saate kadar oda sıcaklığında (20-25oC) tutulabilir. Şehirlerarası bir laboratuvara gönderirken şişeleri 25-35oC arasında tutacak bir portatif inkübatör kullanmak ideal olur. Taşıma esnasında şişelerin aşırı sıcaklık değerlerine (<18oC veya >37oC) maruz kalmasına kesinlikle izin verilmemelidir; köpük kutular iyi bir taşıyıcı olabilir.
12.18.2 Periferik Kanın Alınması
(Sıtma ve Leishmaniasis için Preparat Hazırlanması)
A. Genel Bilgiler
Kalın Damla Preparat Hazırlanması:
- Bir elin orta ya da yüzük parmağının palmar bölgesi, çocuklarda ayak başparmağı ya da topuk alkollü gazlı bez ile temizlenir.
- Alkol kuruduktan sonra, steril, bir lanset batırılır ve kanın serbest olarak çıkması sağlanır (sıkılmaz).
- Bir damla kan lamın ortasına damlatılır. (Resim 10).
- Bu kan damlası bir toplu iğnenin başı ya da diğer bir lamın köşesi ile dairevi hareketlerle yaklaşık 1,5 cm çapında olacak şekilde yayılır.
- Havada kurutulur (min 30 dk).
- KALIN DAMLA PREPARAT ASLA TESPİT EDİLMEZ!
İnce Yayma Preparat Hazırlanması:
- Bir elin orta ya da yüzük parmağının palmar bölgesi, çocuklarda ayak baş parmağı ya da topuk alkollü gazlı bez ile temizlenir.
- Alkol kuruduktan sonra, steril, bir lanset batırılır ve kanın serbest olarak çıkması sağlanır (sıkılmaz).
- Bir damla kan lamın bir ucuna damlatılır.
- 45oC eğimli diğer bir lam damlanın üzerine değdirilir.
- Kan tek bir hareketle lamın bir ucundan diğer ucuna yayılır.
- Yayma havada kurutulur.
- İNCE YAYMA PREPARAT SAF METANOLLE TESPİT EDİLİR.
Resim 10: Periferik kan alma ve preparat hazırlanması
B. Örneklerin Saklama ve Taşınması
Örnek oda ısısında saklanmalı ve laboratuvara gönderilmelidir.
Periferik Kan Yayması İçin Numune Red Kriterleri
- Fikse edilmiş kalın damla kan prepartları.
- Kırılmış preparatlar.
- Lam üzerine incelemeyi engelleyecek şekilde etiket/barkod yapıştırılmış örnekler.
12.19 Serum
- Hastadan tercihen aç karnına jelli serum ayırma tüpüne ~5 mL kan alınır.
- Kan kendiliğinden pıhtılaşana kadar en az 20 dk beklenir. Bu süre en fazla 2 saat olabilir.
- Sonra 2000 devirde 10 dk santrifüj edilmeli, serum ayrılarak steril vidalı kapaklı tüp ile laboratuvara gönderilmelidir. (Resim 11)
Resim 11: Steril vidalı kapaklı tüp
Mantarlara Yönelik Galaktomannan Antijeni Saptanması Amacıyla Örnek Alımı;
- 5 mL sarı kapaklı jelli tüpte ya da 9 mL kırmızı kapaklı kan alma tüpün de 10 dakika 1800 devir/dakika
santrifüjlenerek elde edilen serumdan örnek alınarak çalışma yapılır. Belirgin lipemik ve hemolizli örnekler analiz için kullanılmaz.
- Hastadan tercihen alınan BAL örneklerinden de test çalışılabilir
- Örnek alımından sonra tüplerin kapaklarının çalışma anına kadar açılmaması gerekir. Zira bu durumda kontaminasyon riski yüksek olabilir.
Serum Örneğinin Laboratuvara Taşınma Koşulları
- İl içi gönderilen numuneler 1 saat içinde oda sıcaklığında 1 saati aşan durumlarda buz aküsü ile laboratuvara gönderilir.
- İl dışından gönderilen örnekler santrifüj sonrasında serum, steril vida kapaklı başka bir tüpe aktarılmalı, buz aküsü ile ve üçlü taşıma kabı ile laboratuvara gönderilmelidir.
- Laboratuvara ulaşma süresinin 48 saatten uzun olacağı durumlarda, santrifüj sonrası serum steril bir tüpe aktarılır ve -20/-70 oC'de dondurulur. Dondurulmuş serum buz aküsü ile laboratuvara gönderilir.
12.20 EliSpot Testi için Örnek Alımı ve Taşınması
EliSpot testi Lyme hastalığı tanısında hücresel immünite cevabını ölçen bir test olduğundan taze tam kandan çalışılmaktadır. Numunenin alındıktan sonra bekletilmeden laboratuvarımıza en kısa sürede ulaştırılması lenfositlerin zarar görmemesi adına çok önemlidir.
- 48 saati geçmeyecek transferlerde; test için heparinli veya sitratlı 4 adet tüpe toplamda en az 10 ml olacak şekilde kan alınır.
- 48-72 saat sürebilecek transferlerde (özellikle şehir dışından gelecek numunelerde); test için (Antikoagülan Asit Sitrat Dekstroz Solüsyon A içeren) 2 adet tüpe kan alınır.
- Kan alındıktan sonra en az 4-5 kez tüpler yavaşça alt üst edilir.
- Alınan örnekler kesinlikle buzdolabına koyulmamalı, transfere kadar oda ısısında muhafaza edilmelidir.
- Alınan örnekler laboratuvarımıza en kısa sürede (mümkümse aynı gün) ve oda sıcaklığında (17-25 Co) ulaştırılmalıdır.
- Lenfositler mekanik strese çok hassas olduğundan titreşim ve güçlü sallama gibi işlemlerden kaçınılmalıdır.
12.21 Tüberküloza Yönelik Quantiferon Testi için Örnek Alımı ve Taşınması
Qantiferon testi için özel tüpler kullanılır. Bu özel tüplerin dışında tüp kullanıldığında testi çalışmak mümkün değildir.
- Her hasta için, içinde jel olan kırmızı, gri ve mor kapaklı 3 adet tüpe 1'er ml kan alınır. Numunenin tüpün üzerindeki çizgiyi geçmemesi gereklidir.
- Kan örneğini 1'er ml tüplere aktardıktan hemen sonra; tüp duvarındaki antijenleri çözmek ve iç yüzeylerinin kan ile kaplanmasını sağlamak için 10'ar defa tüpler yavaşça alt üst edilir. Kan hücrelerinin zarar görmemesi için tüpler kesinlikle çok hızlı çalkalanmamalıdır.
- Alınan örnekler aynı gün en kısa sürede laboratuvarımıza oda sıcaklığında (17-25 Co) ulaştırılmalıdır.
- Alınan kan örnekleri buzdolabına koyulmamalı ve dondurulmamalıdır.
Eğer örnek alındığı gün içerisinde laboratuvarımıza ulaşmayacaksa;
- Tüpler 37 oC de 16-24 saat dik pozisyonda inkübe edilir.
- 16-24 saatlik inkübasyondan sonra tüpler 15 dakika 2000-3000 RCF (g) de santrifüj edilerek plazması ayrılır. Bu ayırım işlemi gerçekleşmezse tüpler daha yüksek devirde tekrar santrifüj edilir.
- Santrifüj işleminden sonra tüplerin içerisindeki plazmayı jelle temas etmeden, karıştırmadan dikkatlice boş tüplere aktarılır.
- Plazmaların aktarıldığı sekonder (12x75 mL) tüplere, aktarılan tüpün rengi ve hasta bilgileri yazılır (ad-soy ad-kurum adı veya kurumun hasta barkodu yapıştırılır.)
- Plazması ayrılan bu sekonder tüpler transfere kadar, 2-8 oC' de muhafaza edilir.
- Numuneler 2-8 oC'de özel numune transfer çantasında laboratuvara gönderilir.
12.22 Kemik İliği
Kemik İliği Biyopsisi (Kültür İçin): Aseptik koşullarda en az 0.5 mL alınmalıdır. Heparinize kemik iliğinin hasta yanında uygun kültür besiyerine ekilmesi idealdir. Besiyeri yoksa heparinli (0.2 mg/mL) veya SPS (0.25-0.50 mg/mL) içeren tüplere alınan örnek antikoagülanla homojen bir şekilde karışması için birkaç kez alt-üst edilmelidir. Kemik iliği ve kan örnekleri kesinlikle buzdolabına konulmaz. Örnek 30 dk içinde laboratuvara ulaşamayacaksa izolasyon şansını artırmak için lizis-santrifügasyon tüpüne (pediatrik Isolator) alınması tercih edilir.
Kemik İliği İçin Numune Ret Kriterleri: Pıhtılaşmış örnek
Kemik İliği Biyopsisi (Mikroskopi İçin): Heparinli veya sodyum oksalatlı bir tüpe alınır.
Parazitolojik inceleme için kemik iliği örneği herhangi bir koruyucu içermeyen boş steril tüpe alınarak soğuk zincir koşullarında laboratuvara gönderilmelidir.
Kemik İliği Biyopsi (Parazitolojik Kültür İçin) Numune Ret Kriterleri:
- Koruyucu içeren tüpe alınmış kemik iliği örnekleri.
- Kan kültürü şişesine alınmış kemik iliği örnekleri.
- Enjektör içerisinde gönderilen kemik iliği örnekleri.
12.23 Klinik İzolatlar
Her türlü klinik örnekten üredilmiş izolat (bakteri) çeşitli nedenlerle (doğrulama, serotiplendirme, moleküler tiplendirme, antimikrobiyal direnç, ulusal sürveyans v.b.) referans laboratuvara gönderilebilir.
Gönderilen izolatın taze üretilmiş olması gereklidir. İzolat, plakta katı besiyerinde, transport besiyerinde (yarı-katı) veya sıvı saklama besiyeri (skim milk, %15 gliserollü buyyon vs.) içerisinde gelebilir.
Transferde kullanılacak besiyeri izolatın özelliğine göre seçilmelidir. Enterik bakteriyel patojenlerde Cary-Blair, kömürlü Amies taşıma besiyerleri kullanılabilir. Yine Campylobacter türleri dışındaki patojenler için yatık nutrient agar besiyeri diğer bir seçenektir. Gönderilecek besiyeri mutlaka üçlü paketleme sistemine uygun olarak gönderilmelidir.
12.24 Lenf Nodu/Apse/Yumuşak Doku Aspirasyon Örneği
Deri iyot içeren dezenfektan ile 3 kez silinir, kuruması beklenir. Örnek bir enjektör aracılığıyla aspire edilerek alınır. Lenf bezinde süpürasyon yoksa, doku içine önce enjektör aracılığıyla 0.5-1 mL steril serum fizyolojik enjekte edilir. Sonra aspirasyon yapılır. Alınan örneğin miktarı 1 mL'den az olmamalıdır.
Aspire edilen materyal, herhangi bir koruyucu madde içermeyen steril, vida kapaklı (sızdırmaz) bir tüpe aktarılır.
Lenf Nodu/Apse/Yumuşak Doku Aspirasyon İçin Numune Red Kriterleri:
- Aspirat asla enjektör ile laboratuvara gönderilmemelidir.
- Enjektör ile laboratuvara gönderilen örnekler reddedilir.
12.25 Nazofaringeal Aspirat
İnvaziv bir girişimdir. Bu nedenle hastane koşullarında hekim tarafından alınması uygundur. Numune alımı için hasta sırtüstü yatar pozisyonda ve boyun ekstansiyonda olmalıdır. Hasta koopere olabilirse nefesini tutması istenir ve yumuşak hareketlerle, burundan ince bir kateterle nazofarinkse ulaşılır; şırınga yardımı ile 4-7 mL serum fizyolojik verilip aspire edilerek 2-3 mL numune alınır. Kateter yavaşça geri çekilir ve şırıngadan ayrılır. Aspirat hemen steril, vida kapaklı bir tüpe konur.
12.26 Nazofrinks Sürüntüsü
- Bu işlem için gövdesi burgulu alüminyum şaftlı ve kolayca esneyebilir özellikte, rayon (boğmaca için)/ dacron (viral örnekler için) uçlu özel eküvyonlar kullanılır (Resim 13).
Resim 13: Nazofaringeal sürüntü almak için uygun ince, esnek, alüminyum şaftlı eküvyon örneği; Amies Transport Medium ile birlikte.
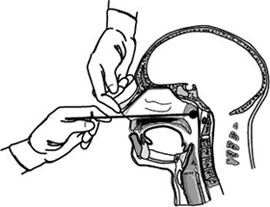
Resim 14: Nazofaringeal sürüntü örneği alınması
- Eküvyon bir burun deliğinden sokularak anterior burun boşluğunun ötesine doğru itilir.
- Nazal kavitenin tabanından nazikce geçirilir ve farinks duvarına kadar ulaşılır. Herhangi bir engel ile karşılaşılıyorsa güç uygulanmaz. Diğer burun deliği denenir.
- Farinks duvarı hissedildiğinde 5 saniye içinde eküvyon hafif döndürülür ve geri çekilir (Resim14).
Alınan numune;
- Bakteriyolojik incelemeler için kömürlü Amies transport besiyerine veya Stuart besiyerine,
- Virolojik incelemeler için, viral taşıma besiyeri içeren tüpe konur.
12.27 Paranasal Sinüs Aspirasyon Materyali
- Kulak-Burun-Boğaz uzmanı tarafından aseptik şartlarda alınır.
- Sekresyon yoksa, sinüs içine önce 0.5-1 mL steril SF enjekte edilir. Alınan örnek miktarı 1 mL'den az olmamalıdır. Aspire edilen materyal steril vida kapaklı tüpe aktarılarak laboratuvara gönderilir.
12.28 Rektal Sürüntü
- Bakteriyel incelemeler için çocuklardan, yoğun bakım hastalarından ve zihinsel engelli hastalardan rektal sürüntü örnekleri alınabilir. Erişkinlerde rektal sürüntü örnekleri önerilmemektedir. Viral ve paraziter tanı için de rektal sürüntü tercih edilmez.
- Rektal sürüntü örneklerinde eküvyonlar anal sfinkterden 2-3cm içeri sokularak rotasyon yaptırılır. Eküvyona gözle görülebilir fekal örnek alındığından emin olunmalıdır. Rektal sürüntü örnekleri nem kaybını önlemek için hemen taşıma besiyerine (Cary-Blair) konulur. Eküvyon tüpün dibine doğru itilir. İkinci eküvyon ile aynı işlem tekrarlanır ve aynı tüpe yerleştirilir. Eküvyonların üstten taşan kısımları kırılır ve tüpün kapağı sıkıca kapatılır. Alınan rektal sürüntü örnekleri kurumaya engel olmak için hemen bir bakteriyel taşıma besiyerine alınmalıdır (Cary Blair veya Amies veya Stuart)
Anorektal cinsel yolla bulaşan enfeksiyon şüphesi olan kişilerde istenecek moleküler testler için rektal sürüntü örneği alınabilir. Rektal sürüntü örneklerinde eküvyonlar anal sfinkterden 2-3cm içeri sokularak rotasyon yaptırılır. Alınan örneğin gaita ile karışmamasına dikkat edilmelidir. Rektal sürüntü örnekleri, nem kaybını önlemek için kalsiyum alginatlı veya dakron uçlu eküvyon ile alınarak Stuart/kömürsüz Amies taşıma besiyerine konulur. Eküvyon tüpün dibine doğru itilir. Eküvyonların üstten taşan kısımları kırılır ve tüpün kapağı sıkıca kapatılır.
Rektal Sürüntü İçin Numune Ret Kriterleri
- Pamuk uçlu eküvyon ile alınan örnekler reddedilir.
- Gaita ile bulaşmış numune reddedilir.
12.29 Servikal Sürüntü
- Serviks ağzında izlenen akıntı/mukus lokal anestezik kullanılmadan temizlenip uzaklaştırılır.
- İnce uçlu dakron veya kalsiyum alginatlı eküvyon ile serviksten girilir.
- Servikste eküvyon rotasyon yaptırılır ve vajen duvarına değdirilmeksizin geri çekilir. (Resim 16)
- Kalsiyum alginatlı veya dakron uçlu eküvyon ile alınan örnek Stuart / kömürsüz Amies taşıma besiyerine konulur.
Servikal Sürüntü İçin Numune Red Kriterleri
- Vajinal flora bakterileriyle bulaşı önlemek olanaksız olduğundan Bartolin bezi eksüdasından eküvyonla gönderilen örnekler işleme alınmaz.
- Pamuk uçlu eküvyon ile alınan örnekler reddedilir.
12.30 Steril Vücut Sıvıları (Perikard, Periton, Plevra ve Sinovya)
- Örnek en az 2 mL alınmalıdır.
- Akciğer dışı tüberkülozu için örnekler 10-15 mL miktarda mümkün olduğu kadar fazla miktarda, steril vida kapaklı tüpte gönderilmelidir. Kanlı numuneler ise SPS (sodium polyanethol sulfonate) ya da heparin içeren tüplerde gönderilmelidir. Örnek aseptik şartlarda hekim tarafından alınarak steril, vida kapaklı bir tüpe aktarılır. Bu numunelerin çoğu fibrinojen içerdiğinden numune üzerine 0.2 mg/mL heparin veya 0.25-0.50 mg/mL SPS eklenir, tüp birkaç kez ters-düz edilir.
- Tercihen hasta başında bir kan kültürü şişesine ekim yapılmalıdır. Yapılamıyorsa örnek steril vida kapaklı bir tüpe aktarılarak gönderilmelidir.
- Laboratuvara hiçbir zaman sıvıya daldırılmış bir swab gönderilmez! Steril Vücut Sıvıları (Perikard, Periton, Plevra Ve Sinovya) İçin Numune Red Kriterleri: EDTA'lı tüpe alınan numune ve pıhtılaşmış numune olması.
12.31 Üretral Akıntı
- Üretral akıntı örneği son idrardan en az 1-2 saat sonra alınmalıdır.
- Kadın ve erkeklerde üretral akıntı varlığında kalsiyum alginatlı veya dakron uçlu eküvyon ile üretra ağzından 2-4 cm içeriye girilir. Üretra içinde eküvyon ile rotasyon yapılarak örnek alınır.
- Eküvyon sapı plastik ya da nikel/kadmiyum telden yapılmış olmalıdır.
- Alınan örnek Stuart / kömürsüz Amies taşıma besiyerine konulur. Taşıma besiyerinin kapağı sıkıca kapatılarak oda ısısında laboratuvara gönderilir.
Üretral Akıntı İçin Numune Ret Kriterleri
- Soğuk zincirde gönderilmiş veya örnek alındıktan sonra buzdolabında bekletilmiş örnekler işleme alınmaz.
- Pamuk uçlu eküvyon ile alınan örnekler reddedilir.
12.32 Vajinal Sürüntü
- Sekresyon ve akıntılar silinir. Örnek iki ayrı eküvyon ile alınır. Bir eküvyon SF içeren Cryo tüp içerisine konularak, diğer eküvyon ise taşıyıcı besiyeri içerisinde gönderilir.
- Numune alımında kullanılan eküvyon çubuklarının uçları genellikle pamuk, dakron, rayon veya kalsiyum aljinattan yapılmıştır. Tahta saplı eküvyonlar toksik ürünler içerdikleri için rutin örnek alımında tercih edilmezler.
- Kalsiyum aljinat uçlu eküvyonlar Chlamydia türlerinin saptanmasına yönelik örnek alınmasında uygundur. N. gonorrhoeae ve U. urealyticum üzerine toksik etki gösterebilirler.
Bakteri kültürü amacıyla alınan örnekler uygun taşıma besiyeri veya uygun ısı sağlansa dahi 24 saatten fazla saklanmaz. Örnek alındıktan sonra hemen ekilmelidir, hemen ekilmesi mümkün değilse oda ısısında ≤ 24 saat saklanabilir.
- Çevre koşullarına oldukça duyarlı olan organizmaları (N. gonorrhoeae, H. ducreyi, anaeroplar gibi) içerebilecek örnekler için taşıma süresinin uygun taşıma besiyeri kullanılsa dahi 6 saati aşmaması önerilmektedir.
Not: Vulva-vajina kandidozu şüphesinde; Vajinal akıntıdan ve vajinal duvarındaki kalın beyaz yapışkan plaklardan steril eküvyon ile alınan örnekler, taşıma besiyeri ile laboratuvara gönderilmelidir.
Vajinal Sürüntü İçin Numune Ret Kriterleri
Pamuk uçlu eküvyon ile alınan örnekler reddedilir.
12.33 COVID-19 Klinik Numune
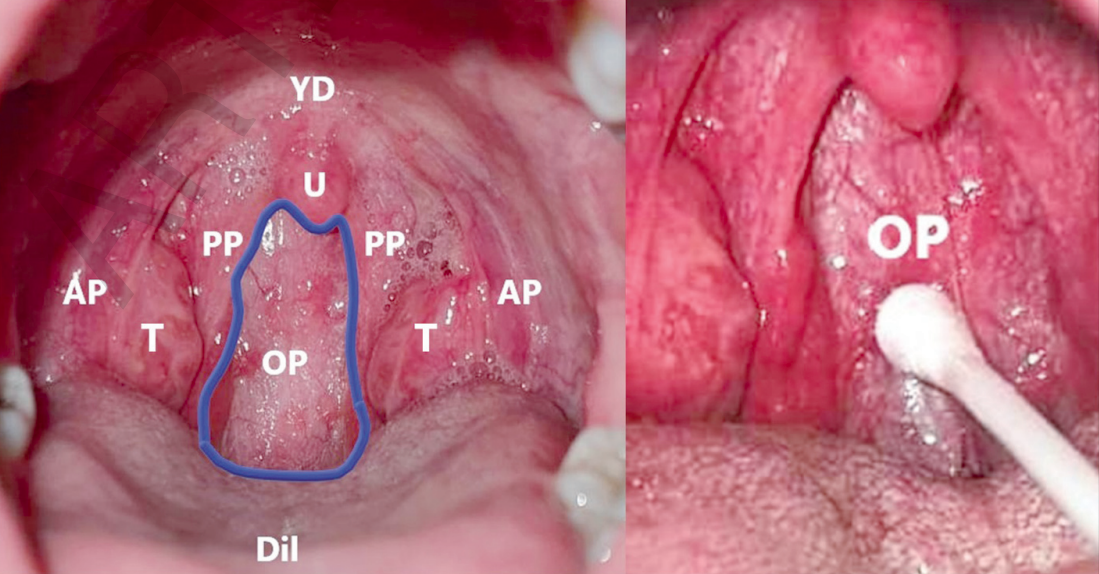
Laboratuvarımızda Covid-19 tanısı için ayaktan tedavi edilen hastalarda, nazofaringeal ve orofaringeal sürüntü örnekleri alınmaktadır. İdeal olarak önce orofaringeal sürüntü alındıktan sonra aynı swab kullanılarak burundan da örnek alınmalı ve aynı taşıma besiyerine konulmalıdır. Aynı hastadan alınan orofaringeal ve nazal sürüntü numunesi ayrı bir besiyerinde gönderilmemelidir. Alınan numuneler viral transport medium, vtm içine konulup ağzı sıkıca kapatılarak laboratuvara gönderimi sağlanmalıdır. Orofaringeal numune alınırken; bir dil basacağı ile önce dile bastırılmalı ve orofarinks posteriol duvarı görülür hale getirilmelidir. Ardından test çubuğunun ucu dile, dil köküne, tonsillere ve yumuşak damağa dokunmayacak şekilde posteriol faringeal duvara yuvarlama hareketi ile sürtülmelidir. Çubuğun ucunu sekresyonla ıslandığı görülmelidir. Sonrasında çubuk etrafa değdirilmeden dışarı çıkarılır ve nazofaringeal numune alma aşamasına geçilir. Nazofaringeal numune alırken; nazal septum deviasyonu ve konka hipertofisi gibi nazal pasaj problemleri olan hastalar olabilir ve sürüntü almada problemler yaşanabilir. Bu nedenle işlem öncesinde hastanın hangi burun deliğinden daha iyi nefes aldığı sorgulanmalıdır. Gerekirse tek tek burun delikleri kapatılarak hangisinden daha rahat nefes aldığı belirlenmelidir. Test çubuğu bu burun deliğinden geçirilerek damağa paralel şekilde ilerletilerek test çubuğunun ucunun ıslanması sağlanmalıdır. Test çubuğu burun deliklerinden içeriye derinlik olarak dış kulak hizasına gelecek mesafeye kadar ilerletilmeli (8-10 cm) ve nazofarinkse ulaşıldığı hissedilmelidir. Salgıları emmek için test çubuğu birkaç sn. bu alanda tutulmalıdır. Sonrasında test çubuğunu döndürerek yavaşça çıkarılmalıdır. Hareketlerin oldukça kibar bir şekilde yapılması hem hastanın irritasyonunu azaltır hem de kanamanın önüne geçer.
Orofaringeal duvar haricinde oral kaviteden örnek alınması, test çubuğunu nazofarinks posterioruna kadar ulaşmadan burun içerisinde kalması gibi hatalı örnek alımları yalancı negatif sonuçların verilmesine sebebiyet verir.
Resim 15:
Örnek çubuğu nostrilden içeriye sokulduktan sonra döndürme hareketiyle yumuşak damağa paralel şekilde derinlik olarak DKY hizasına kadar 8-10 cm alt meadan ilerlenir, nazofarinks posterior duvarı hissedilir ve burada da çubuğun ucu ıslatılacak şekilde birkaç saniye döndürülür ve işlem sonlandırılır.
Oral kavite ve orofarinks görüntüsü. T; Tonsil, OP; Orofarinks posterior duvar, YD; Yumuşak damak, AP; anterior plika, PP; posterior plika.
- Olası vaka tanımına uyan ve enfeksiyon bulguları ağırlaşarak devam eden kişilerden alınan ilk numunenin üst solunum yolu numunesi olması ve test sonucunun negatif olması; COVID-19 şüphesini dışlamaz.
12.35 Klinik Dışı Örnekler
12.35.1 Çevresel İzolatlar: Doğrulama, ileri identifikasyon, serotiplendirme, antibiyotik duyarlılık araştırması için uygun besiyerinde taze izolat pasajları gereklidir.
12.35.2 Entomolojik Örnekler:
Bit, pire için; yerleşimine göre vücut, giysi, saç veya pubik bölgeden alınan etken steril, ağzı sıkıca kapalı plastik kap içerisinde laboratuvara gönderilir. Uyuz için derideki sillionlar veya papüllerden iğne veya bisturinin sivri ucu yardımıyla kazıntı numuneleri alınır. Önce lezyon bulunan alan alkol ile dezenfekte edilip kuruması beklenir. Alan steril bir bisturi ile kazınır. Kazıntı hemen yerinde incelenecekse veya hastanenin laboratuvarına gönderilecekse lam üzerine konur. Bir damla %10 KOH damlatılıp üzeri lamelle kapatılır ve bir lam taşıyıcı içerisinde gönderilir.
Uzak bir laboratuvara gönderilecekse boş bir tüpe veya bir-iki damla %10 KOH içeren bir tüpe alındıktan sonra kapağı sıkıca kapatılarak gönderilir.
Keneler uygun şekilde (Resim 17) çıkarılıp saf alkol içeren sızdırmaz, vida kapaklı kaba aktarılır.
Buna göre ucu ince ve yassı bir penset/kene kartı yardımıyla, kene vücuda en yakın noktasından nazikçe ve sağlam bir şekilde kavranır. Yukarıya doğru kararlı bir şekilde çekilerek kenenin kendini bırakmasını beklenir. Kenenin vücuduna dokunulmamalıdır! (Emdiği kanı geri boşaltmasına yol açar). Yukarı doğru çekme esnasında kene döndürülmemelidir (ağız parçasının kopmasına ve deri içinde kalmasına neden olabilir). Kendini bırakan kene uygun kaba alınır ve laboratuvara gönderilir.

Resim 16: İnce ve yassı uçlu bir penset veya cımbız yardımıyla kene çıkarılması işlemi.
12.35.4 Çevresel Numuneler
Parazitolojik incelemeler: Su, çamur, gıda gibi çevresel numuneler dıştan vidalı kırılmaya dayanıklı kaplarla gönderilmelidir.
Tularemi İçin Su Numuneleri
Çeşme ve Benzeri Yerlerden Su Numunesi Alınması
- Çeşmenin musluk başlığındaki aparatlar varsa çıkarılır ve musluk çevresi alkol ile iyice silinir ve/veya alevden geçirilir. Salgın araştırması için alınan numunelerde bu işlemler yapılmaz.
- Çeşmeden belirli bir süre (normal koşullarda 15-30 sn) kuvvetle su akıtılır. Salgın araştırması için alınan numunelerde bu işlem yapılmaz.
- Numune şişesi gerekli hijyen koşullarına özen gösterilerek kapağı açılır, şişe ağzı dipten tutularak yeniden alevden geçirilir. Gerekli ise şişenin dış kısmı %70 alkol bazlı bir dezenfektanla silinir ve kuruması beklenir.
- Şişe doldurularak ağzı, şişe kapağının iç kısmına el değdirilmeden dikkatli şekilde kapatılır.
Havuz ve Benzeri Yerlerden Su Numunesi Alınması
- Suyun durgun halde olduğu ve kullanılıyor ise dezenfektanın kararlı hale geldiği yer seçilir.
- Hijyenik şartlara dikkat edilerek numune şişesi kenardan yaklaşık 50 cm içeriden ve yüzeyin ~30 cm derine daldırılarak numune alınır.
- Su yüzeyindeki kontaminasyonun önüne geçmek için şişe baş aşağı olacak şekilde gerekli derinliğe daldırılıp numunenin alınacağı noktada ağız kısmı 45o açı ile tutularak şişe doldurulur.
Ambalajlı Su Numunesi Alınması
- Ambalajlı numuneler orijinal ambalajında ve bütünlüğü bozulmamış şekilde gönderilmelidir.
Su Numunelerinin Alımında Kullanılan Şişelerin Özellikleri
- Tüm su çeşitleri için istenen mikrobiyolojik parametrelerde kullanılacak su şişeleri, bu amaç için üredilmiş plastik (PP, PE) veya cam numune şişeleri olmalıdır. Numune şişeleri sızdırmaz özellikte olmalıdır.
- Dezenfekte edilen veya dezenfekte edildiğinden şüphe edilen tüm su çeşitleri, Sodyum tiyosülfatlı şişelere alınmalı ve Sodyum tiyosülfat oranı şişe üzerinden izlenebilmelidir.
- Tüm su çeşitleri için numune alımından sonra şişelerin yaklaşık 1/10'luk kısmı boş bırakılır.
- Tüm su çeşitleri için en az 500 mL numune gönderilmelidir.
Biyogüvenlik Önlemleri
- Her türlü klinik örnek "enfeksiyöz" kabul edilmeli ve bu örnekleri alırken, dokunurken, çalışırken standart güvenlik önlemleri alınmalı ve kişisel koruyucu ekipman (önlük, eldiven, gerektiğinde maske) giyilmelidir.
- Numune alımında kullanılan kaplar steril, kırılmaya dayanıklı, dıştan vidalı kapaklı olmalı ve sıvıları sızdırmamalıdır.
- Enjektör ile alınan numuneler (b) şıkkında belirtilen kaplara aktarılarak gönderilmelidir.
- Damlatan veya ağzı açık kaplarda numune gönderilmemelidir.
Legionella Analizi İçin Su Numuneleri
Legionella Kontrol Programı kapsamında mevzuata uygun olarak gerçekleştirilir. Su numuneleri, vaka tanısı konduktan (vakanın ihbarı yapıldıktan) hemen sonra, etken için kaynak olduğu düşünülen bina su sistemine herhangi bir dekontaminasyon işlemi uygulanmadan önce alınmalıdır.
Mikrobiyolojik test sonuçlarının doğruluğu örneğin alınma şekli ve nakli ile doğrudan ilişkilidir. Bu el
kitabında örneklerin alınma, toplanma, nakil kuralları ile ilgili bilgiler ayrı bölümler halinde hazırlanmıştır.
13.NUMUNELERİN SAKLANMASI
Laboratuvarın çalışma prensibi olarak, Laboratuvarımıza gelen ve kaydı yapılıp çalışılan birincil numuneler, ileri tetkikler veya analizin başarısızlığına bağlı analiz tekrarları için Serumlar; buzdolabında/derin dondurucuda 10 gün, tam kan örnekleri; buzdolabında 10 gün boyunca saklanır. Eğer testler çalışma gününden önce geldiyse, çalışma gününe kadar stabilitesine uygun saklama koşullarında saklanır. Daha uzun süreli saklamaya ihtiyaç duyulursa -20oC'de saklanır. Saklama/dayanıklılık koşulları ile ilgili ayrıntılı bilgiler Ahenk Laboratuvarı Test Listesi'nde mevcuttur. Şayet ilave bir analiz talebiniz olursa burada yer alan süre ve analiz için gerekli şartlara göre talebiniz karşılanacaktır. İlave numune ihtiyacı olması durumunda tarafınıza mutlaka bilgi verilecektir.